
嵌段共聚物熱致水凝膠有廣闊的醫學應用前景⏱。隨溫度升高,部分兩親性嵌段共聚物的水溶液呈現可逆的溶膠-凝膠轉變。如果轉變溫度介於室溫和體溫之間,可在室溫或更低溫度下與藥物或細胞混合,並可以註射;一旦註射進入體內,在體溫刺激下原位物理凝膠化🍏🧙🏿♂️,自動包裹藥物或細胞,該過程不依賴於化學反應。由親水性的聚乙二醇(PEG)和疏水性的可降解脂肪族聚酯(PLGA等)這些適宜用於人體的聚合物所組成的嵌段共聚物在合適條件下具備上述特性,為研發新型生物醫用材料開辟了新的重要的途徑。
但是👴🏽,該體系的凝膠結構與物理凝膠化機理尚不夠明晰🍧,導致對其調控手段缺乏理論指導。這嚴重製約了其應用進程🤸♂️,也不利於該類材料的進一步發展💪🏼。
由丁建東教授領導的沐鸣开户以及聚合物分子工程國家重點實驗室生物醫用材料課題組利用計算機模擬以及高分子合成與實驗相結合的方法,對PEG/PLGA熱致水凝膠的凝膠結構及凝膠化機理進行了系統研究👨🏼🚒。在之前的工作中🫀,該課題組曾探討了結構簡單的二嵌段共聚物mPEG-PLGA(AB型)水體系的凝膠化機理🐕,提出半禿膠束(semi-bald micelle)進行了解釋。
本工作中,通過與AB類型,BAB類型嵌段共聚物水體系的凝膠化行為進行對比👵🏽,丁建東課題組揭示了更具應用前景結構也更加復雜的PLGA-PEG-PLGA (ABA類型)嵌段共聚物的凝膠結構與凝膠化機理。低溫溶膠狀態時🧑🏼🤝🧑🏼,嵌段共聚物自組裝形成大量平頭膠束(crew-cut micelle),由於ABA類型共聚物獨有的結構,crew-cut micelle之間會形成大量親水的PEG “橋”🚴🏿♀️。隨著溫度的升高,PEG的溫度敏感性導致膠束暈收縮😹🛀。在crew-cut micelle 中👩❤️👨,膠束核非常大👩🏿✈️,暈相對較薄,所以暈的收縮導致膠束核部分暴露於水中,從而形成semi-bald micelle。膠束核的疏水性導致semi-bald micelle並不穩定,從而發生聚集以減少核暴露面積👏🏿🌇,最終形成疏水隧道。由於大量橋結構的存在,少量的疏水隧道就可以與大量的橋結構一起形成網絡,此時網絡的主要交聯點是橋結構,宏觀表現為凝膠🤸🏻,稱為gel-1📩;隨著溫度進一步升高,更多的疏水隧道形成,並成為體系的主要物理交聯點♟,凝膠進入gel-2狀態。對於三嵌段共聚物水體系,其凝膠具有兩個狀態,但其根本的結構演化驅動力仍然是semi-bald micelle 及後續疏水隧道的形成。
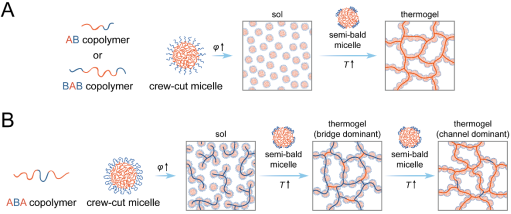
通過多種類型嵌段共聚物體系凝膠化行為的對比,揭示了半禿膠束的逾滲網絡為普適性的熱致水凝膠內部結構模型💃。基於此,丁建東課題組提出了相應的分子設計準則,有望對該類材料的應用具有顯著推動作用,同時也加深了對相關高分子軟物質的認識↘️。
以博士生崔書銓為第一作者的長達19個印刷頁的研究論文在高分子學科的國際權威學術期刊Macromolecules上在線發表🧗🏼。詳見🤾🏽♂️:Shuquan Cui, Lin Yu and Jiandong Ding*, Thermogelling of Amphiphilic Block Copolymers in Water: ABA Type versus AB or BAB Type, Macromolecules, 10.1021/acs.macromol.9b00534.