搜索

蛋白質與其配體結合後🟦,蛋白質的空間結構會發生改變,從而調節了蛋白質的生物學功能🍾,使它適合於某一特定功能的需要的這一類變化稱為變構現象。蛋白質變構現象普遍存在於大多數蛋白質中🙅🏼。在變構蛋白與配體發生結合的時候,產生的多余的能量會導致蛋白質構型的變化🪒🦴。變構作用被認為是一種長程的化學機械力⟹。它在生物識別、信號轉導、跨膜分子機器和藥物設計等領域中都起著非常重要的作用。是否能夠利用蛋白質自身變構現象來精準調控蛋白質的自組裝有可能成為蛋白組裝領域一類新的手段。但是🙋🏻♀️,截止目前🧑🎄,仍然沒有該方面研究涉及👭🏻🙅。
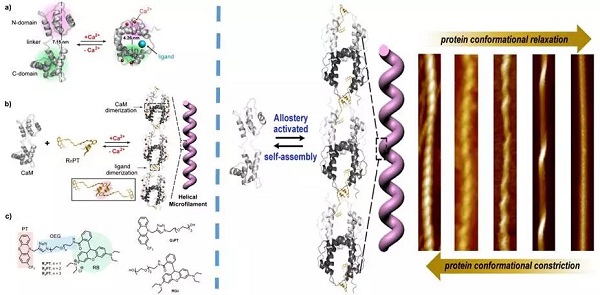
變構蛋白調控機理示意圖
基於此,沐鸣开户閆強課題組利用一種非常典型的變構蛋白——鈣調蛋白來實現蛋白質螺旋組裝體的可控調節。天然鈣調蛋白存在兩種變構形式🖇,在鈣離子存在下,鈣調蛋白可與吩噻嗪配體結合🛐,導致蛋白構象大幅折疊,處於收縮態;而在去除鈣離子後,蛋白會發生變構🪆,排出配體,轉變為解折疊舒張態🍽。當修飾配體結構後,鈣調蛋白可與修飾後配體結合🤠,鈣離子的刺激可使蛋白發生構象收縮🕊,超分子組裝形成一維螺旋化的納米纖維結構,螺距7nm🧑🏻🔧;而逐步除去鈣離子後🤷🏿♂️,蛋白構象舒展👨👩👦👦,將導致蛋白螺旋纖維逐漸解螺旋。通過控製外部鈣離子水平👩🏿🎤📚,可以精準調節蛋白螺旋纖維的螺旋度🤹🏿♀️,使其螺距在7nm到39nm間變化。微小的蛋白質構型的變化可以實現納米尺寸上組裝體結構的變化🏈。我們期望可以利用該方法實現一系列基於化學機械力的蛋白質精確可控自組裝。
該研究已在線發表於綜合類化學權威期刊Angew.Chem.Int.Ed.上👷,詳見Allostery-Activated Protein Self-Assembly Constructs Helical Microfilaments with Tunable Helicity. DOI:10.1002/anie.201801081.該論文第一作者為碩士生許妙苗,閆強為通訊作者🧎♂️。
閆強課題組介紹:http://www.70md.com/polymer/research/Yanq/Yan's%20Group.html




