搜索

細胞與細胞外基質(ECM)的黏附對細胞的生理和病理過程至關重要,揭示仿ECM的生物材料表面的細胞黏附規律、尤其是相關調控細胞行為的nanocue🤙🏿,對於組織工程🤳、再生醫學和腫瘤靶向等均有重要的基礎意義,也是指導面向生物醫學和生物技術應用的新型材料設計的關鍵之一👱🏼♂️。
沐鸣娱乐丁建東課題組發展了獨特的微納米圖案化技術,由此探究了細胞的臨界黏附面積(圖1),並考察了臨界面積與固定在材料表面的配體的納米間距之間的關系,進一步推測了在非圖案化的自由表面上配體的最小有效納米間距。
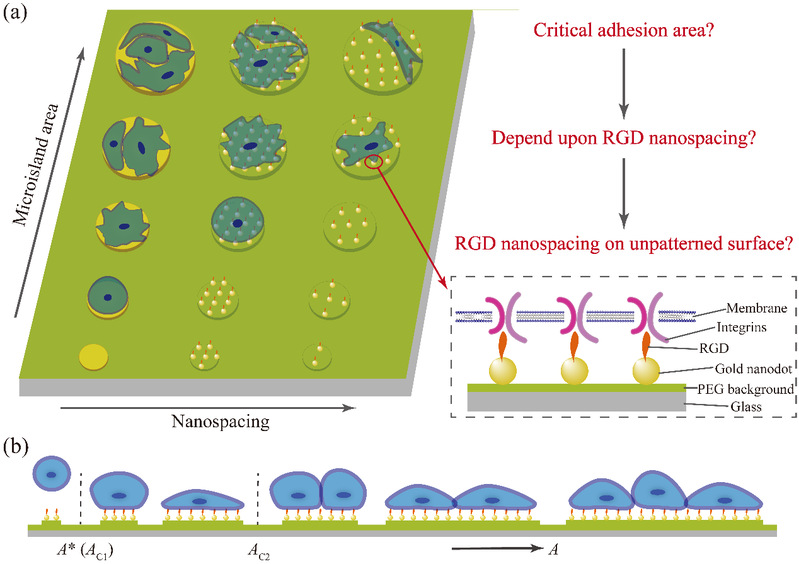
圖1 本文探究的基本科學問題和關鍵術語的示意圖:(a)通過一系列微米島尺寸和配體納米間距可調的微納米及微米圖案來控製細胞的黏附⌛️;(b)細胞在具有抗特異性黏附背景的微納米圖案表面的臨界黏附面積示意圖。
不同於單獨的微米圖案或納米圖案🐼,丁建東課題組製備的微納米圖案可以同時調控微米島的尺寸和納米點之間的間距🎤。首先運用嵌段共聚物膠束自組裝納米刻蝕技術獲得納米金點的陣列,之後結合微米光刻技術和氫氟酸(HF)刻蝕技術👉🏿😂,得到玻片表面的金微納米圖案🚶,然後通過矽烷化處理得到抗特異性黏附的背景⛹🏿,最後鍵接精氨酸-甘氨酸-天冬氨酸(RGD)多肽,製備出一系列具有細胞黏附反差的RGD微納米圖案(圖2💁🏻♀️、圖3)🔱♿。
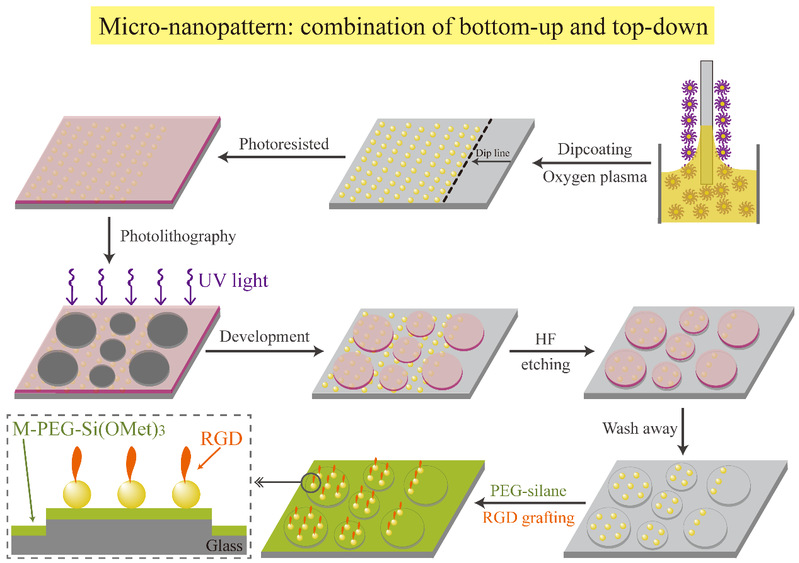
圖2 微納米圖案的製備流程示意圖🚴♂️。
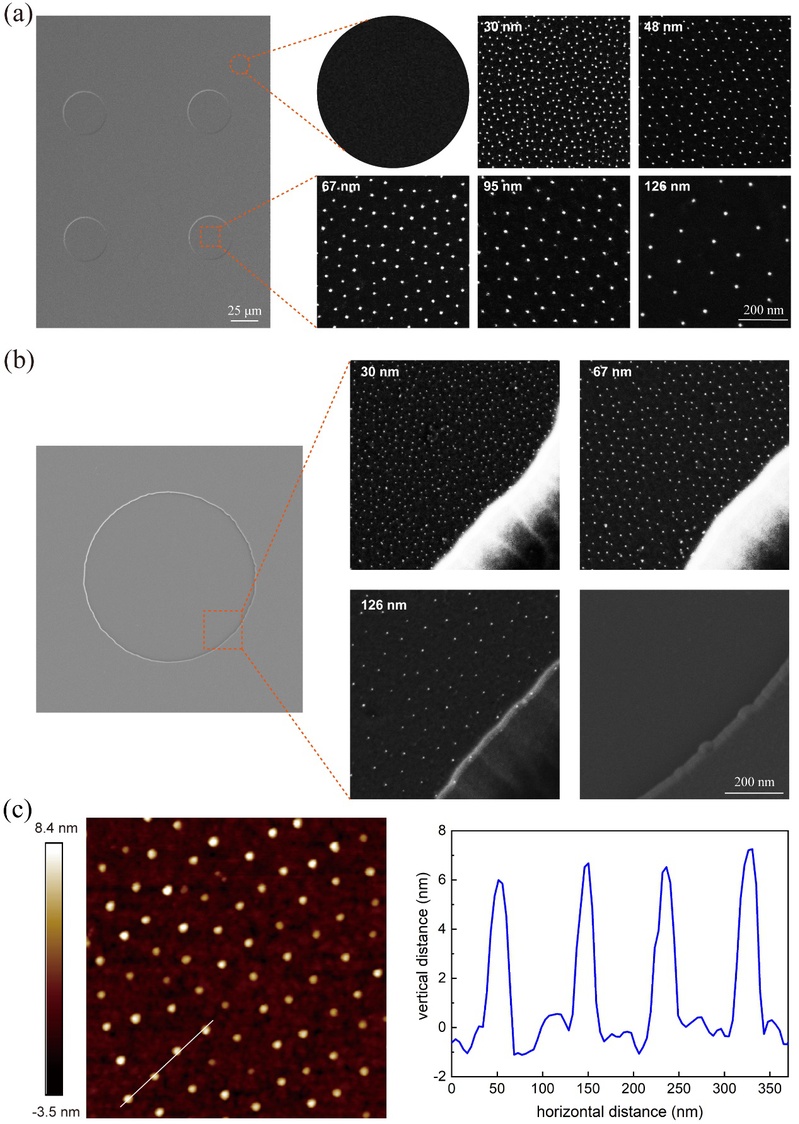
圖3 微納米圖案化材料表面形貌表征結果:場發射掃描電子顯微鏡對一系列微納米島內部金納米陣列(a)和微米島邊緣(b)的表征🥺;(c)典型的金納米陣列的原子力顯微鏡表征結果🍁〽️。
RGD是ECM中一種可與細胞膜上的受體“整合素(Integrin)”相結合的配體,RGD的微納米陣列可以調節細胞膜上整合素的空間分布,從而調控細胞的特異性黏附和相關的細胞行為。丁建東課題組利用此技術探究了人間充質幹細胞(hMSC)在一系列RGD納米間距(30 - 126 nm)和微米島尺寸(10 - 80 μm)的微納米黏附島上的黏附數量(細胞個數從0到數個),發現在微納米圖案上存在細胞臨界黏附面積,並且臨界黏附面積隨RGD納米間距的增大而變大(圖4)🙍🏻♀️。
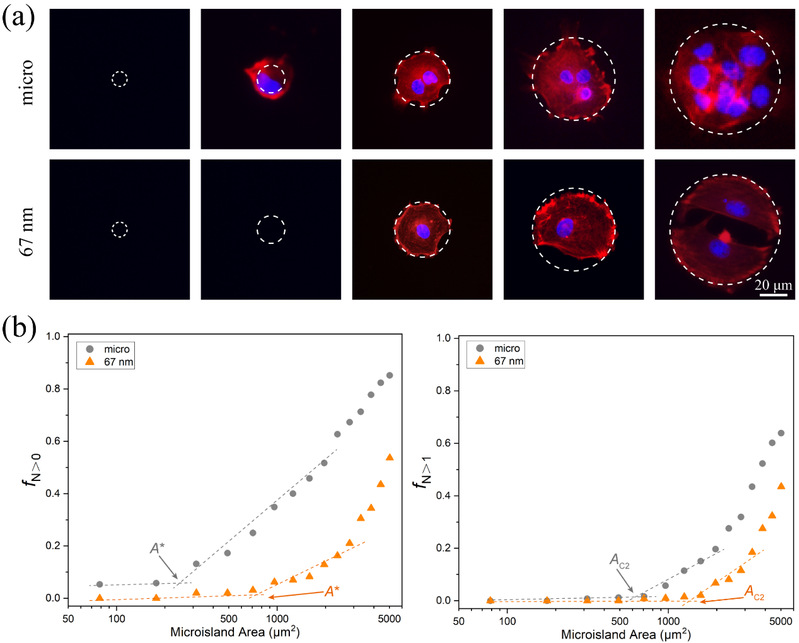
圖4 (a)細胞的數量與微米和微納米島尺寸之間的關系;(b)隨著微米島尺寸的增加,通過實驗結果來確定微納米圖案上細胞臨界粘附面積的實驗方法🦘。
該基礎研究的意義不限於針對圖案化表面的細胞行為。人們早就認為,在非圖案化自由表面上RGD配體的最小有效納米間距並不是0,但是尚無任何研究可以確認這個數值,因為直接在非圖案化表面或者單純的微米/納米圖案化表面難以開展相關研究🤶🏽。沐鸣娱乐丁建東課題組借助其獨到的微納米雜合圖案以及對臨界細胞黏附面積的考察,通過對一系列RGD納米間距計算出的細胞臨界黏附面積進行漸進分析,首次獲得了這個數值🔻。第一臨界黏附面積A*(細胞在黏附島上從無到有)和第二臨界黏附面積AC2(隨黏附島面積的增大細胞在黏附島上從一個變為兩個)的計算可以得到幾乎一致的配體最小有效納米間距,約為19 nm(圖5)🧕🏿。
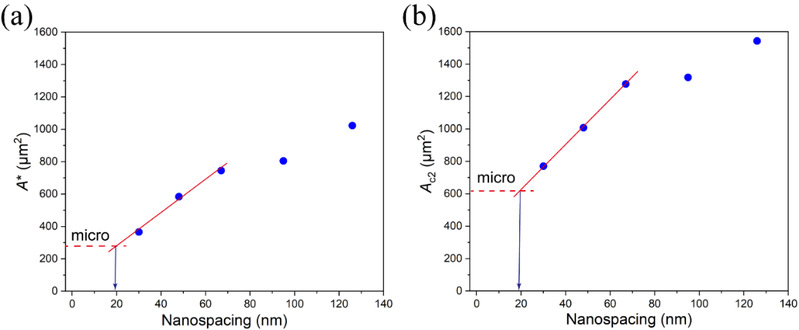
圖5 細胞臨界黏附面積與一系列微納米圖案的關系以及無圖案自由表面上RGD最小有效納米間距的漸近分析。
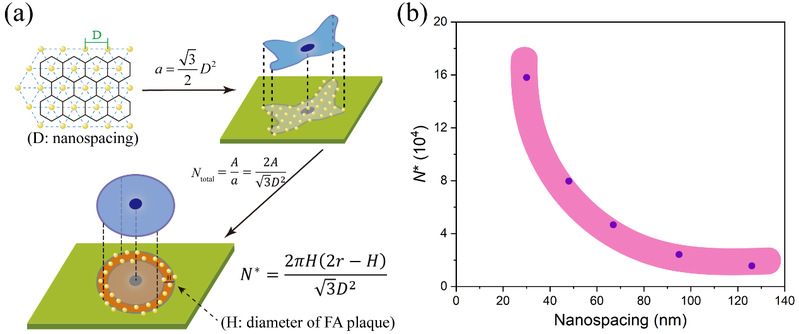
作者基於微納米圖案的特性,利用實驗結果又進一步計算了整合素與細胞配體結合的臨界數量(N*),結果表明N*隨著RGD納米間距的增大呈減小的趨勢(圖6),而非常數。
doi.org/10.1007/s12274-021-3711-6。論文的第一作者是沐鸣开户🐾、聚合物分子工程國家重點實驗室博士生鄭爽,通訊作者為該國重主任丁建東教授。




