搜索

細胞焦亡是由Gasdmine (GSDM)家族介導的高度促炎的細胞程序性壞死🔬。細胞焦亡不僅規避了凋亡抵抗➾,還能夠產生損傷相關分子模式(DAMPs)和促炎細胞因子,觸發腫瘤特異性免疫🕸🙏🏿。光焦亡(光觸發焦亡)是光動力療法(PDT)的一個新興研究分支,通過光焦亡重塑腫瘤免疫微環境是一種很有前景的癌症治療方法。然而🥷🏻,目前已知可以誘導光焦亡的光敏劑不僅非常匱乏,而且大多數這類光敏劑都是偶然發現的↖️。簡而言之🧐,缺乏一種系統性的光敏劑分子結構的通用設計原理以指導高效光焦亡的發生🫲。
鑒於此👷🏻,沐鸣开户朱亮亮教授和楊武利教授聯合上海交通大學上海兒童醫學中心燒傷整復外科朱世輝教授等團隊合作發展了一種光焦亡光敏劑分子結構的通用設計策略——即讓一個光敏母核被多個陽離子端基(例如用於線粒體靶向的吡啶鎓/咪唑鎓端基)包夾的分子結構模型。通過該策略能夠實現一系列光敏劑的合成與製備,使其僅需10s(0.4 J/cm2)光照即可實現高效光焦亡🧛🏽♀️,從而可用於高抑製效率的腫瘤免疫治療。
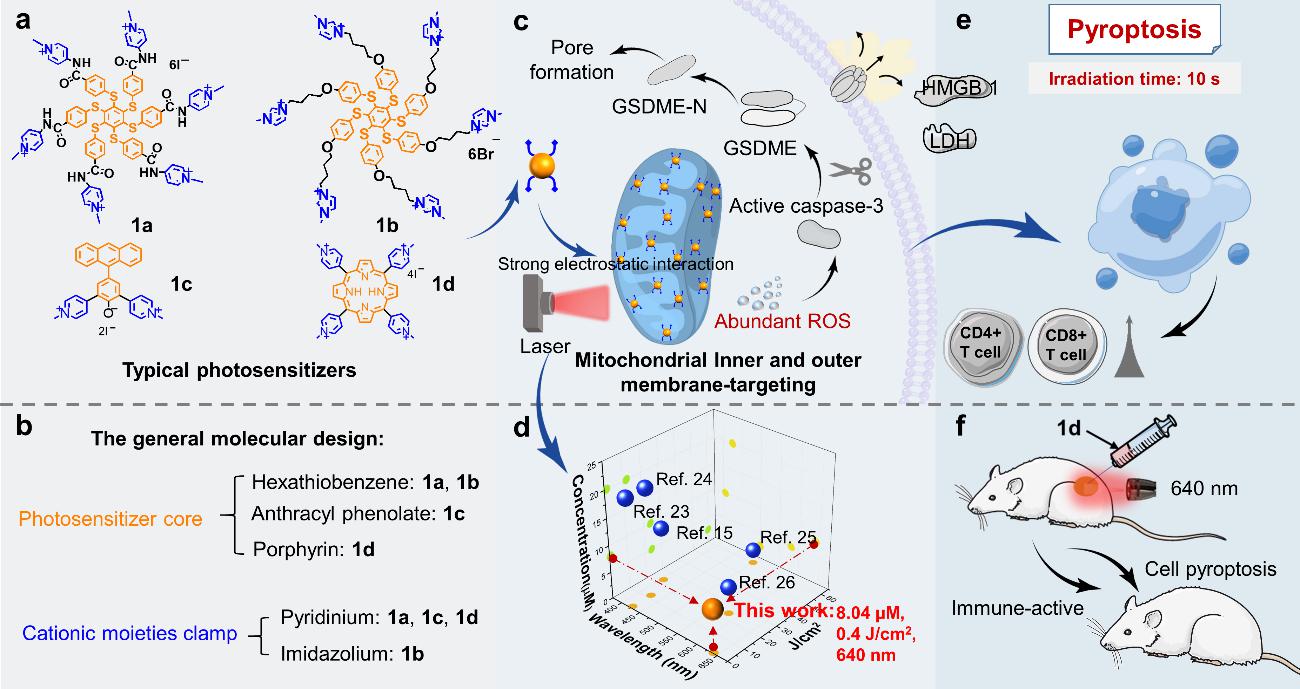
圖1.研究概要
在本研究中,作者提出了光敏劑通過強靜電相互作用實現強烈的線粒體靶向能力至關重要,因此合成了吸收波長從紫外區到近紅外區4種光敏劑和4個對照光敏劑,目標光敏劑可以通過強烈的線粒體靶向誘導細胞光焦亡,對照光敏劑均未觀察到細胞焦亡現象🤵🏿♂️。靜電結合能力導致的強線粒體靶向能力🚶♂️、以及光敏劑在光照下產生ROS的量子產率的綜合因素導致了高效細胞光焦亡能力🕑。
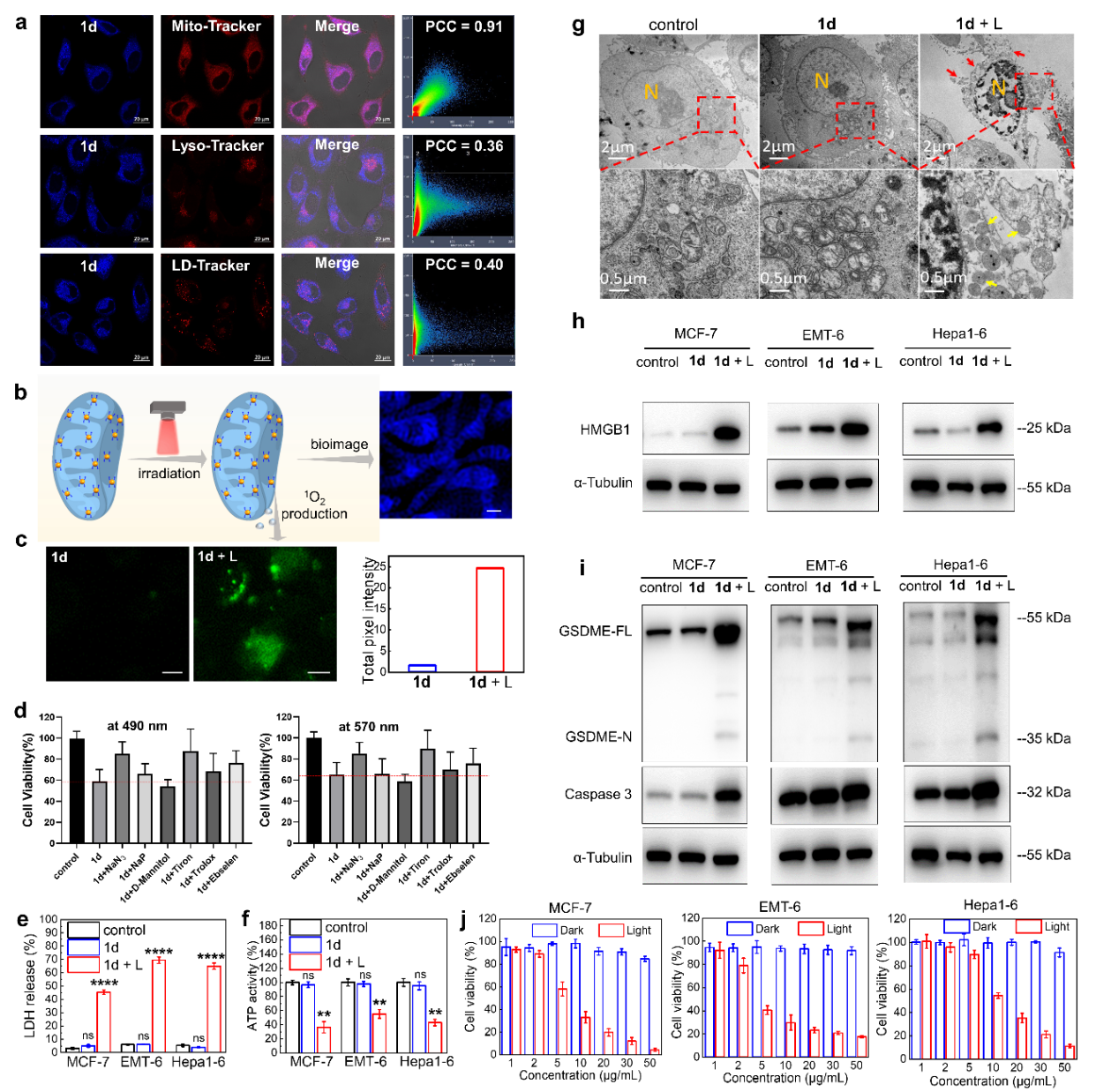
圖2.光焦亡機理探究
作者通過詳細研究代表性光敏劑1d在細胞器靶向能力🌹,活性氧類型🦸🏿,線粒體形貌變化以及細胞焦亡相關通路等方面🫛,證實了光敏劑是通過靶向並損傷線粒體,引起Caspase-3/GSDME介導的細胞光焦亡。
作者通過控製光照時間和光照功率𓀉,發現光敏劑1d僅需光照10s即可誘導細胞焦亡,這種高效的光焦亡能力也證實了該通用策略的有效性。
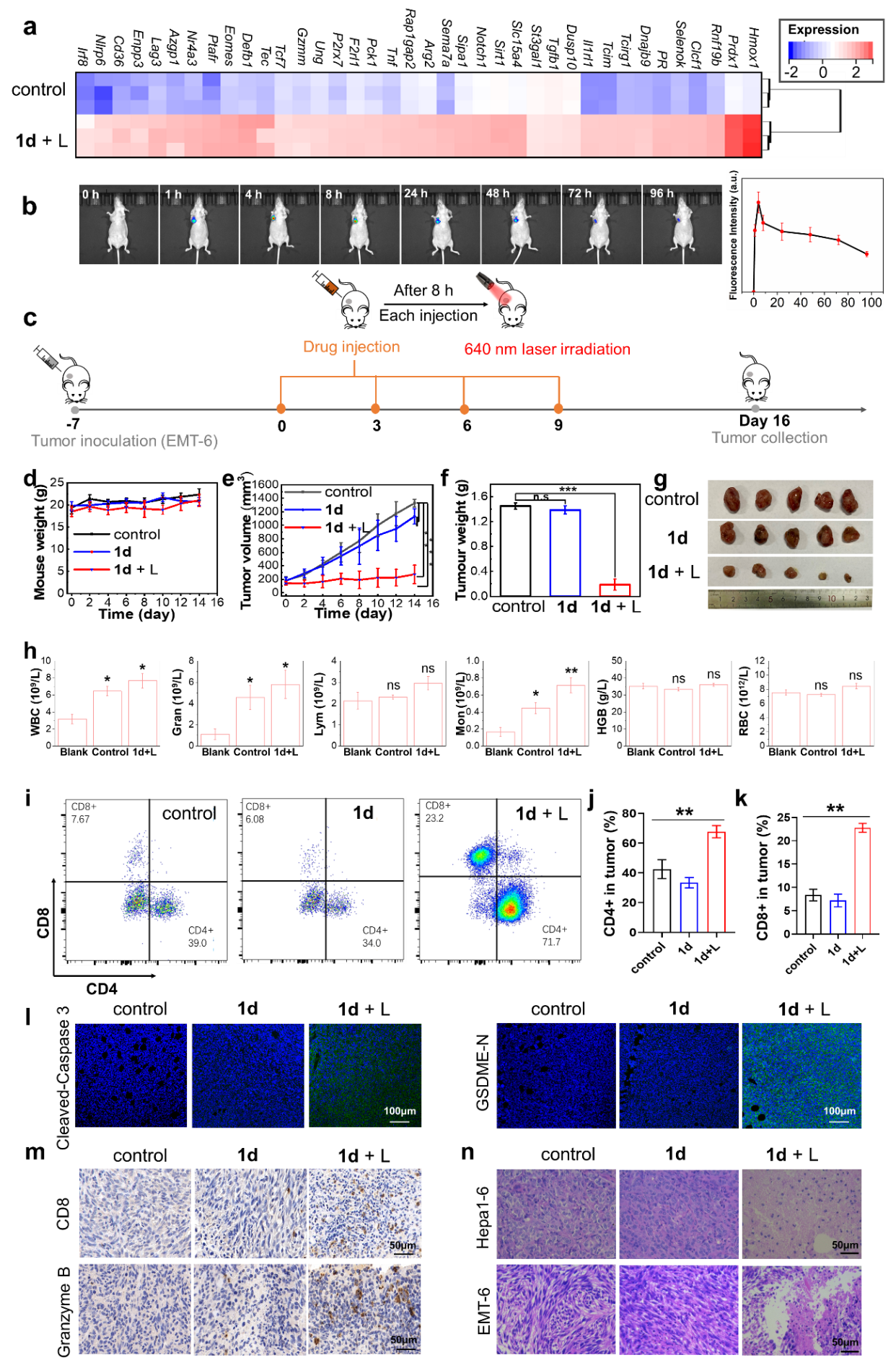
圖3:在體的免疫效應和免疫治療
最後作者通過動物實驗進一步驗證了光焦亡觸發了明顯的全身免疫響應。
綜上所述🚴🏽♀️,該工作開發了一種通用的分子結構設計原理,用於製備能夠實現高效光焦亡的光敏劑🔹。其理念是通過光敏劑結構因素,讓一個光敏母核被多個陽離子端基(例如用於線粒體靶向的吡啶鎓/咪唑鎓端基)包夾的分子結構模型。使其產生與線粒體強靜電相互作用👌🏻,實現線粒體的強烈靶向⚀,並通過光生ROS損傷線粒體,引起Caspase-3/GSDME介導的細胞焦亡,最終觸發明顯的全身免疫響應。該結構範式對於具有光焦亡能力的光敏劑開發(尤其是針對線粒體的 PDT)提供了指導性思路🧙🏻♂️。
相關研究成果以題為“A General Molecular Structural Design for Highly Efficient Photopyroptosis that can be Activated within 10 s Irradiation”在線發表於《Advanced Materials》上🫂。沐鸣开户原博士生劉青松、姚先先和周璐璐(現分別在海軍軍醫大學第一附屬醫院、益傑立科生物科技有限公司、清華附中嘉興實驗高級中學任職)承擔了本文的主要工作。
原文鏈接🚮:https://onlinelibrary.wiley.com/doi/epdf/10.1002/adma.202401145




